¿Qué sabemos sobre la adaptación, supervivencia y tratamientodel parásito Trichomonas vaginalis (Doneé, 1836)?
M. C. Francisco Javier Rangel-Mata
Dr. Dennis Adrián Infante-Rodríguez
Resumen
En el mundo biológico, los parásitos y sus hospederos están en un constante “combate”, coevolucionando para sobrevivir uno frente al otro. Un ejemplo claro es el protozoario Trichomonas vaginalis (Doneé, 1836), causante de la tricomoniasis, la infección de transmisión sexual no viral más común en el mundo, que afecta a un aproximado de 275 millones de personas. El objetivo de este trabajo es generar información de divulgación sobre la tricomoniasis, enfocándonos en las características generales de la enfermedad, la relación parásito-hospedero, el proceso de infección, así como la respuesta del sistema inmunológico del hospedero contra dicha enfermedad.
Palabras clave: tricomoniasis, parásito, infección, sistema inmunológico.
Abstract: In the biological world, parasites and their hosts are in a constant “battle”, co-evolving to survive against each other. A clear example is the protozoan Trichomonas vaginalis (Doneé, 1836), which causes trichomoniasis, the most common non-viral sexually transmitted infection in the world, affecting approximately 275 million people. The objective of this work is to generate information about trichomoniasis, focusing on the general characteristics of the disease, the parasite-host relationship, the infection process, as well as the response of the host immune system against said disease.
Introducción
Un parásito es un organismo que vive en o sobre otro organismo, conocido como huésped, del cual obtiene nutrientes y protección, generalmente a costa del bienestar de este último. Los parásitos dependen del huésped para sobrevivir, ya que no pueden obtener todos los recursos necesarios por sí mismos, siendo el huésped el organismo que proporciona esos recursos, sufriendo daños a menudo, que pueden ir desde molestias leves hasta enfermedades graves, ya que el parásito puede interferir con las funciones normales del cuerpo, debilitar el sistema inmunológico o incluso causar la muerte en casos extremos. Este tipo de relación se caracteriza por un desequilibrio, donde el parásito se beneficia mientras el hospedero sufre las consecuencias.
A lo largo de la historia hemos aprendido que las guerras, más allá de traer muerte y destrucción, también contribuyen indirectamente en el desarrollo tecnológico, la adaptabilidad y otros cambios que mantienen el equilibrio entre los países. De la misma forma que en una carrera armamentista las diferentes especies biológicas toman sucesivas medidas y contramedidas, unas respondiendo a las otras, esta serie de cambios mantiene el equilibrio entre diferentes especies como el parásito y su huésped. Así, huésped y parásito están, por definición, en combate uno contra el otro (Van Gerwen et al., 2023). Este combate recíproco resulta en un proceso de selección, de evolución simultánea, con cambios continuos en ambos, resistencia del hospedero e infectividad del parásito (Graves et al., 2020 y Muzny et al., 2022).
Metodología
La información utilizada para la redacción de este artículo de divulgación fue consultada en revistas de alto impacto indexadas, entre ellas: BioMed Research International, Journal of Infection and Public Health, Parasitology, Journal of Clinical Microbiology, entre otras revistas científicas. Así mismo, se amplió la información a través de búsqueda en revisiones especializadas sobre el tema y material publicado en organismos oficiales internacionales, como los centers for disease control and prevention (CDC).
Desarrollo
Tricomoniasis, una infección de transmisión sexual
A través del tiempo, los parásitos han desarrollado diferentes estrategias para evadir el sistema inmune del hospedero; este es el caso del protozoario Trichomonas vaginalis (Doneé, 1836), que fue considerado hasta los años cincuenta como un organismo comensal. Fue en esta década cuando el entendimiento de su papel como causante de tricomoniasis, una infección de transmisión sexual, comenzó a evolucionar (Van Gerwen et al., 2021).
Actualmente entendemos que T. vaginalis biológicamente se clasifica dentro del tipo de parasitismo conocido como “parasitismo obligado”. Esto significa que T. vaginalis depende completamente de un hospedero humano para sobrevivir, crecer y reproducirse, ya que no puede completar su ciclo de vida fuera del cuerpo humano (figura 1).
Proceso general de infección
La T. vaginalis se adhiere a las células epiteliales de la vagina o del tracto urogenital masculino y femenino, donde se alimenta y prolifera. Este parásito utiliza una variedad de mecanismos para evadir la respuesta inmunitaria del hospedero y asegurar su supervivencia, como la fagocitosis de células epiteliales, bacterias y glóbulos blancos para obtener nutrientes esenciales. Además, libera enzimas y otras moléculas que dañan los tejidos del hospedero y modulan la respuesta inmune, permitiéndole establecer una infección persistente (Allsworth et al., 2009; Van Gerwen et al., 2021).
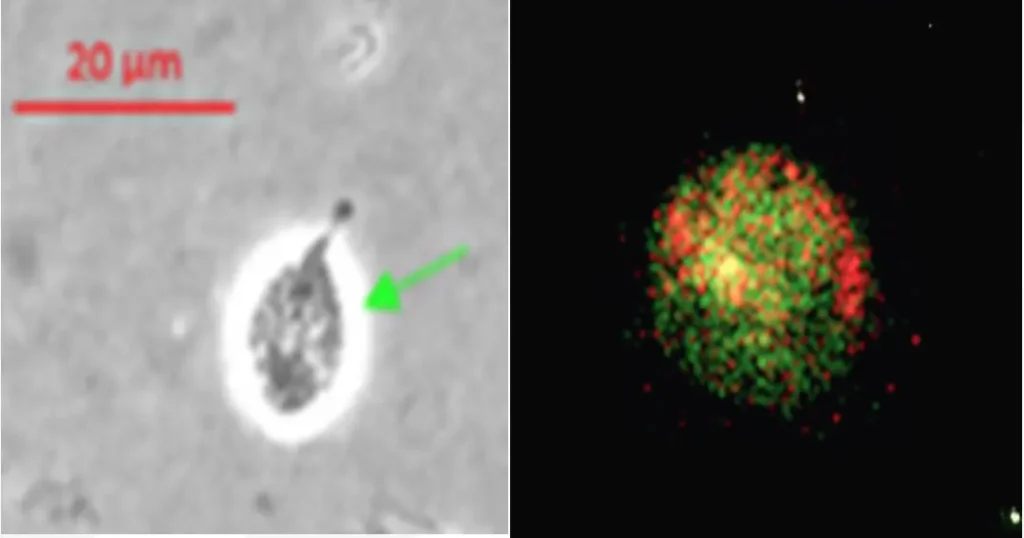
Figura 1. Parásito Trichomonas vaginalis. Izquierda, en campo claro observamos al parásito Trichomonas vaginalis marcado con flecha verde; se puede apreciar su forma característica de pera y su flagelo largo que se desprende del cuerpo. Derecha, linfocito Tc observado en microscopio confocal.
Estrategias de ataque
Hay algunos avances que tratan de explicar la interacción entre T. vaginalis y las células del hospedero. Este parásito ha desarrollado diversos mecanismos para infectar, entre estos existen mecanismos de “lucha cuerpo a cuerpo”, por contacto con las células del hospedero; o de “combate a distancia”, liberando productos en el ambiente interno del organismo. Entre los primeros, está la habilidad de este parásito para la rápida transformación de los trofozoítos a partir de una forma piriforme flagelada en “nado libre” a células de forma ameboidea con mayor adherencia. La adhesión del parásito a las células epiteliales en la vagina es un paso crítico en la infección, en la cual tanto adhesinas como la forma ameboidea de este parásito tienen significante contribución. La fagocitosis constituye otro mecanismo patogénico de T. vaginalis, que es capaz de devorar bacterias como Staphylococcus aureus, Lactobacillus spp., Escherichia cloacae, Escherichia coli y Pseudomonas aureoginosa. Este peculiar parásito no solo come bacterias, sino también células de mamífero, como células epiteliales, glóbulos rojos y glóbulos blancos (Juliano et al., 1987 y Midlej et al., 2009). Se tiene evidencia de que este parásito utiliza los glóbulos rojos del hospedero como una fuente alternativa de hierro y de lípidos, además, el parásito usa la fagocitosis de los glóbulos blancos (Arroyo et al., 2015).
No solo el contacto directo y la adherencia a los tejidos permiten que este parásito cause daño; en los años ochenta, el doctor Pindak y su equipo reportaron que filtrados de cultivos del parásito contenían un factor que podía causar daño a las células. Hoy día, se conoce que el parásito secreta proteasas, como cisteín proteasas, que llevan a cabo funciones indispensables en la patología del parásito. En este combate a distancia, el parásito T. vaginalis es capaz de liberar sustancias que regulan la respuesta de defensa del hospedero, como el leucotrieno B4, que hace que las células
de defensa liberen sustancias y mensajeros, como la interleucina IL-8, la cual sirve como un quimioatrayente para otras células, o pequeñas vesículas llamadas exosomas, que interfieren en la producción de citocinas y de esta forma
“interrumpen la comunicación entre las células inmunes” para poder establecer la infección (Olmos-Ortiz et al., 2017).
Estrategias de defensa
En contraparte, hemos desarrollado todo un arsenal para combatir esta parasitosis, sin embargo, el microorganismo ha logrado adaptarse y resistir a casi todo. En la actualidad, el tratamiento de elección para este padecimiento es el metronidazol, no obstante, este parásito, entre sus “avances militares” ha logrado desarrollar estrategias que en ocasiones le permiten resistir a este fármaco, haciendo de gran importancia científica la búsqueda de nuevas estrategias para combatirlo, entre ellas, la búsqueda de una vacuna que alerte la respuesta inmune previa a la infección (Cudmore et al., 2010).
El tratamiento estándar para la tricomoniasis ha sido, durante décadas, el metronidazol, un antibiótico que es eficaz en la mayoría de los casos. Sin embargo, la aparición de cepas de T. vaginalis resistentes a este fármaco ha impulsado la investigación y desarrollo de nuevos tratamientos y enfoques terapéuticos. Estos avances en tratamientos buscan no solo erradicar la infección, sino también reducir las complicaciones asociadas con la tricomoniasis, mejorando la calidad de vida de los pacientes y enfrentando el desafío de la resistencia a los fármacos tradicionales (figura 2).
- Tinidazol: similar al metronidazol, el tinidazol es un fármaco antiparasitario que ha demostrado ser eficaz contra T. vaginalis, incluyendo algunas cepas resistentes al metronidazol. Se considera una alternativa cuando el metronidazol falla o no se tolera bien.
- Secnidazol: este es un fármaco de la misma familia que el metronidazol y tinidazol, pero con una ventaja significativa: puede administrarse en una dosis única, lo que mejora la adherencia al tratamiento. Su eficacia contra T. vaginalis es comparable y es una opción en casos donde la simplicidad del tratamiento es crucial. Sin embargo, las estrategias adquiridas por el parásito han ido evolucionando a través de esta batalla: Puede consultar la susceptibilidad y/o resistencia del parásito a través de los centers for disease control and prevention (CDC) o a través de la siguiente liga: https://www.cdc.gov/laboratory/specimen-submission/detail.html?CDCTestCode=CDC-1023916
- Terapias combinadas: en algunos estudios se ha explorado el uso de terapias combinadas, donde se administra metronidazol junto con otros fármacos antiparasitarios o antibacterianos. Este enfoque busca superar la resistencia y mejorar la erradicación del parásito.
- Investigación en vacunas e inmunomoduladores: dado que T. vaginalis interactúa de manera compleja con el sistema inmune, se están investigando vacunas e inmunomoduladores como estrategias futuras para prevenir la infección y reducir la severidad de los síntomas (Cudmore et al., 2010).
- Nuevas moléculas: se están explorando nuevas moléculas con actividad antiparasitaria que actúen mediante mecanismos distintos a los fármacos actuales. Estas investigaciones aún están en fases tempranas, pero representan una esperanza para futuros tratamientos más efectivos.
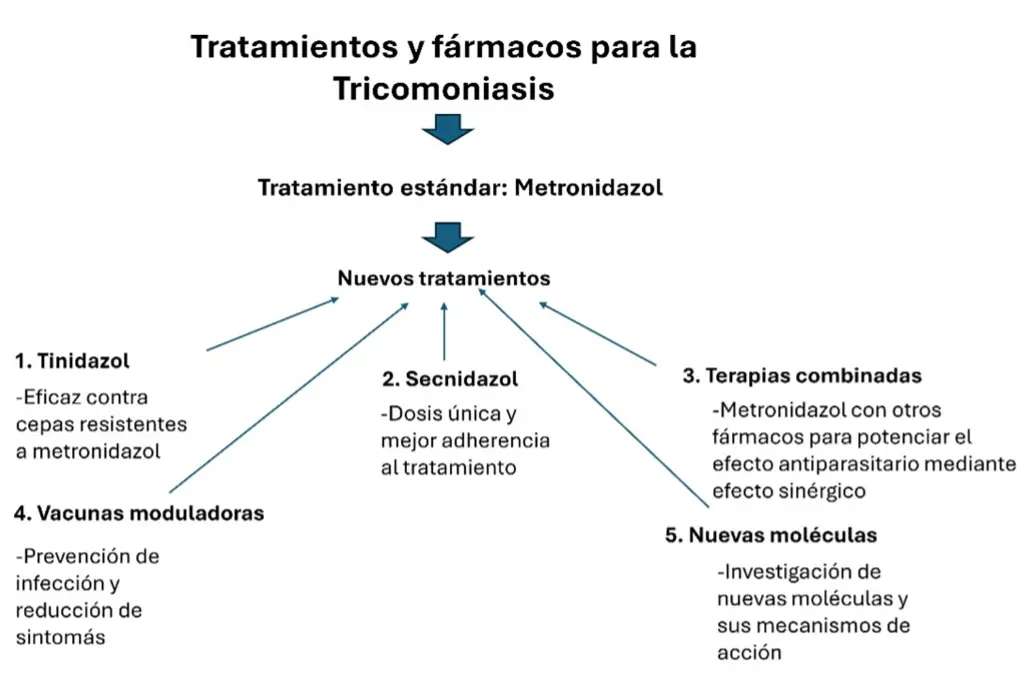
Figura 2. Diagrama que especifica los principales tratamientos y fármacos disponibles actualmente contra la Tricomoniasis.
Resultados
La tricomoniasis tiene distribución cosmopolita y ha sido identificada en todos los grupos raciales y estratos socioeconómicos. El hospedero natural de este parásito es el humano. El parásito es transmitido de una persona a otra, usualmente por contacto sexual. A pesar de la alta incidencia de la infección, los procesos bioquímicos esenciales y los mecanismos celulares que llevan a la patogénesis no son del todo conocidos.
La tricomoniasis tiene implicaciones de importancia social, médica y económica; puede afectar a hombres y mujeres, sin embargo, en los hombres la mayoría de los casos son asintomáticos, en cambio, las mujeres muestran signos como comezón, dolor, descargas vaginales y estar infectadas durante el embarazo las predispone a ruptura de membranas placentarias, partos prematuros, bajo peso de infantes al nacer e, incluso, infertilidad (Rangel-Mata et al., 2021). La tricomoniasis es capaz de causar lesiones locales en el sitio de infección, como lesiones sistémicas. En la figura 3, podemos observar el aumento del tamaño del bazo (esplenomegalia) en ratones infectados con este parásito (figura 3). Esta infección también se ha ligado al incremento en la incidencia y severidad de cáncer cervicouterino y prostático, así como a la transmisión del virus del papiloma humano (VPH) y del virus de inmunodeficiencia humana (VIH) (Allsworth et al., 2009).
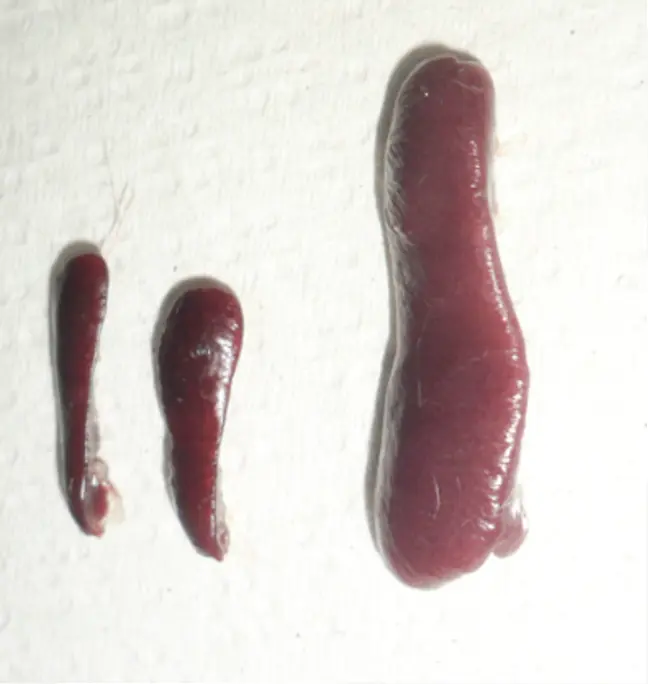
Figura 3. Esplenomegalia en ratones causada por Trichomonas vaginalis. Izquierda, bazos de tamaño normal; derecha, bazo aumentado de tamaño después del proceso infeccioso. Esto nos permite apreciar que los daños causados por este parásito van más allá de lo local.
Conclusión
La T. vaginalis habita en la vagina de las mujeres infectadas, un ambiente relativamente hostil con un marcado pH ácido y escasos nutrientes; sin embargo, el parásito ha evolucionado para ajustarse al ambiente del hospedero, para contrarrestar e incluso “manipular” la respuesta inmune (inmunomodulación). Además de esto, ha “aprendido” a contrarrestar los efectos de medicamentos antiparasitarios. El parásito sufre una metamorfosis, se adhiere a las células del hospedero, libera diferentes sustancias que le permiten esquivar el sistema inmune y dañar a las células; asimismo, es capaz de adquirir nutrientes a través de un eficiente proceso fagocítico. Todas estas estrategias han sido desarrolladas para lograr sobrevivir en el bélico ambiente vaginal y tomar ventaja en esta carrera armamentista entre hospedero y parásito.
Nuestro papel como científicos es divulgar información y buscar las estrategias que nos permitan aventajar en esta interacción mediante la prevención, el descubrimiento y/o el diseño de nuevos fármacos, a través del entendimiento y fortalecimiento de la respuesta inmune, así como el desarrollo de vacunas e inmunomoduladores que nos permitan vencer a esta enfermedad.
Referencias
- Allsworth, J. E., Ratner, J. A. & Peipert, J. F. (2009). Trichomoniasis and Other Sexually Transmitted Infections: Results From the 2001-2004 National Health and Nutrition Examination Surveys. Sexually Transmitted Diseases, 36(12), 738-744. https://doi.org/10.1097/olq.0b013e3181b38a4b
- Arroyo, R., Cárdenas-Guerra, R. E., Figueroa-Angulo, E. E., Puente-Rivera, J., Zamudio-Prieto, O. & Ortega-López, J. (2015). Trichomonas vaginalis Cysteine Proteinases: Iron Response in Gene Expression and Proteolytic Activity. BioMed Research International, 1-24. https://doi.org/10.1155/2015/946787
- Cudmore, S. L. & Garber, G. E. (2010). Prevention or treatment: The benefits of Trichomonas vaginalis vaccine. Journal of Infection and Public Health, 3(2), 47-53. https://doi.org/10.1016/j.jiph.2010.01.003
- Graves, K. J., Novak, J., Secor, W. E., Kissinger, P. J., Schwebke, J. R. & Muzny, C. A. (2020). A systematic review of the literature on mechanisms of 5-nitroimidazole resistance in Trichomonas vaginalis. Parasitology, 147(13), 1383-1391. https://doi.org/10.1017/s0031182020001237
- Juliano, C., Monaco, G., Bandiera, P., Tedde, G. & Cappuccinelli, P. (1987). Action of anticytoskeletal compounds on in vitro cytopathic effect, phagocytosis, and adhesiveness of Trichomonas vaginalis. Sexually Transmitted Infections, 63(4), 256-263. https://doi.org/10.1136/sti.63.4.256
- Midlej, V. & Benchimol, M. (2009). Trichomonas vaginalis kills and eats – evidence for phagocytic activity as a cytopathic effect. Parasitology, 137(1), 65-76. https://doi.org/10.1017/s0031182009991041
- Muzny, C. A., Van Gerwen, O. T. & Legendre, D. (2022). Secnidazole: a treatment for trichomoniasis in adolescents and adults. Expert Review of Anti-infective Therapy, 20(8), 1067-1076. https://doi.org/10.1080/14787210.2022.2080656
- Olmos Ortiz, L. M., Barajas Mendiola, M. A., Barrios Rodiles, M., Castellano, L. E., Arias Negrete, S., Ávila, E. E. & Cuéllar Mata, P. (2017). Trichomonas vaginalis exosome like vesicles modify the cytokine profile and reduce inflammation in parasite infected mice. Parasite Immunology, 39(6). https://doi.org/10.1111/pim.12426
- Pindak, F. F., Gardner, W. A. & De Pindak, M. M. (1986). Growth and cytopathogenicity of Trichomonas vaginalis in tissue cultures. Journal of Clinical Microbiology, 23(4), 672-678 https://doi.org/10.1128/jcm.23.4.672-678.1986
- Rangel-Mata, F. J., Ávila-Muro, E. E., Reyes-Martínez, J. E., Olmos-Ortiz, L. M., Brunck, M. E., Arriaga-Pizano, L. A. & Cuéllar-Mata, P. (2021). Immune cell arrival kinetics to peritoneum and role during murine-experimental trichomoniasis. Parasitology, 148(13), 1624-1635. https://doi.org/10.1017/s0031182021001311
- Van Gerwen, O. T., Camino, A. F., Sharma, J., Kissinger, P. J. & Muzny, C. A. (2021). Epidemiology, Natural History, Diagnosis, and Treatment of Trichomonas vaginalis in Men. Clinical Infectious Diseases, 73(6), 1119-1124. https://doi.org/10.1093/cid/ciab514
- Van Gerwen, O. T., Opsteen, S. A., Graves, K. J. & Muzny, C. A. (2023). Trichomoniasis. Infectious Disease Clinics of North America, 37(2), 245-265. https://doi.org/10.1016/j.idc.2023.02.001